Elektron İlgisi ve Elektron İlgisinin Özellikleri
Elektron ilgisi, gaz hâlindeki bir mol atomun, bir mol elektron kazanması sırasındaki enerji değişiminin bir ölçüsüdür. Elektron ilgisi Eİ harfleri ile gösterilir. Birimi kJ/mol (kiloJoule/mol) cinsinden verilir.
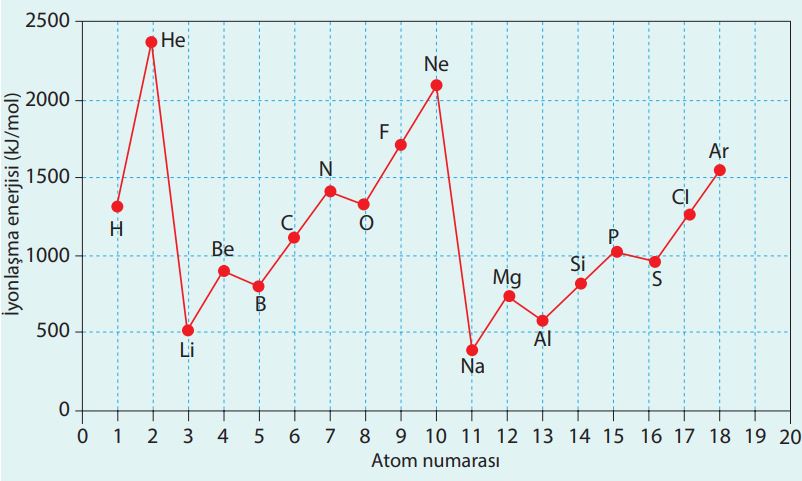
Element atomlarının çoğunda, atom elektron kazandığı zaman enerji açığa çıkar. Bu şekilde bir atomun elektron alması yani elektron ilgisi değeri ekzotermik (ısı veren) bir değerdir. Ancak 2 ve 18. grup elementleri kendiliğinden elektron almazlar. Bu element atomlarının elektron almaları endotermik (ısı alan) tepkimeler sonucunda oluşur. Bazı element atomlarının elektron ilgilerini tepkime denklemleri ile birlikte inceleyelim.
Flor (F), klor (Cl) ve lityum (Li) element atomlarının elektron ilgileri negatif değerlidir. Eİ değerinin negatif olması sadece enerjinin dışarıya verildiğini gösterir. Buna göre klor atomunun elektron ilgisi flordan büyüktür. Magnezyum 2. grup elementidir ve Eİ değeri pozitif işaretlidir.
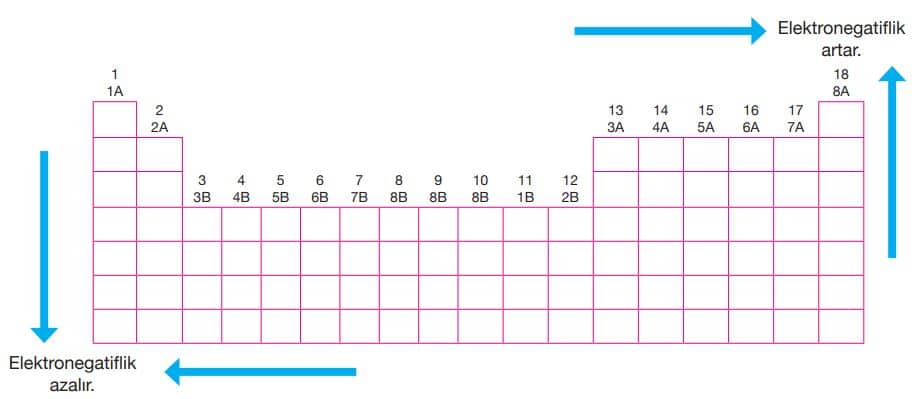
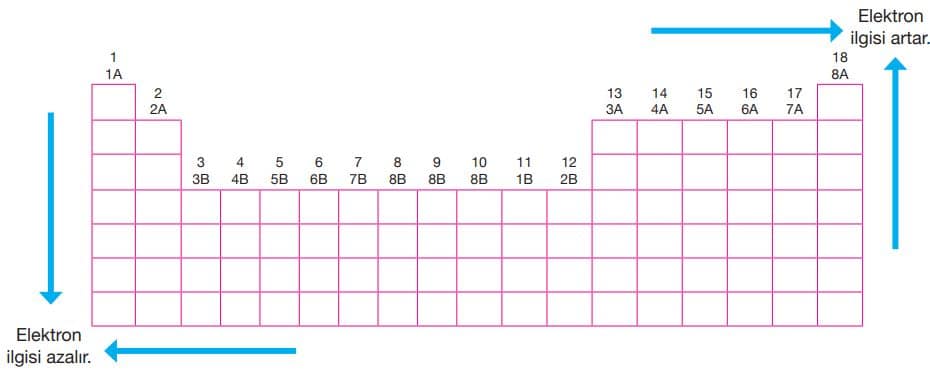
Periyodik sistemde genel olarak atom yarıçaplarının küçüldüğü yönde elektron ilgisi değerleri artar. Buna göre bir periyotta sağ tarafa, bir grupta yukarıya doğru gidildikçe genel olarak elektron ilgisi artar. Ancak periyodik sistemde elektron ilgisi en büyük element klor (Cl) elementidir.

Periyodik sistemde elektron ilgisi değerlerinin genel değişimi yukarıdaki tabloda verilmiştir.