Hidrojen Bağı Nedir?
Hidrojen atomunun azot (N), oksijen (O) veya flor (F) gibi elektronegatifliği yüksek atomlar ile oluşturduğu moleküller arasında oluşan polar etkileşime özel olarak hidrojen bağı denir.
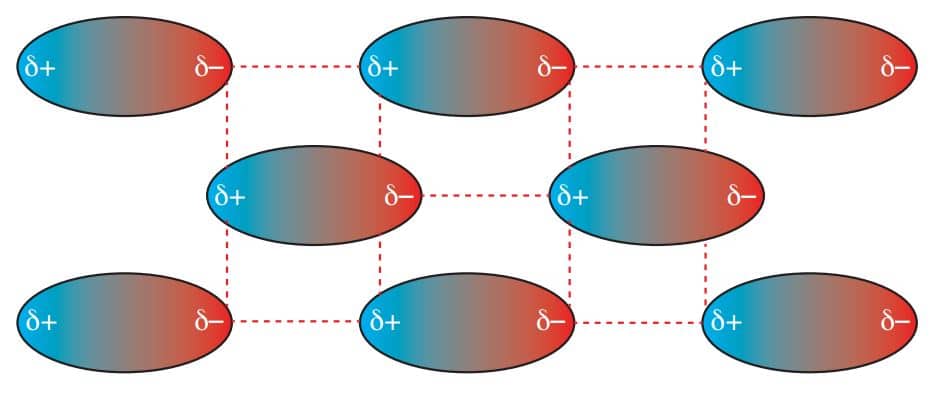
Hidrojen bağı polar bir etkileşim olmasına karşın dipol – dipol etkileşimine göre daha kuvvetli olduğu için ayrıca hidrojen bağı olarak tanımlanır.
H2 O, NH3 ve HF gibi bileşik moleküllerinde bulunan hidrojen atomları N, O veya F atomlarından birisine bağlı olduğu için bu moleküller arasında aşağıdaki şekilde görüldüğü gibi hidrojen bağları oluşur.
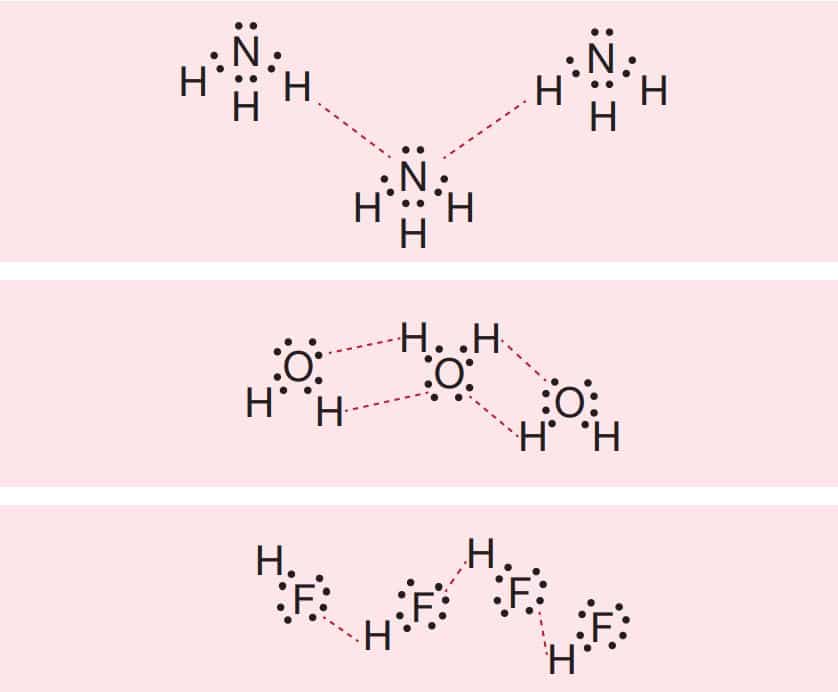
Farklı tür moleküller arasında da hidrojen bağı oluşabilir. Su (H2 O) ve metil alkol (CH3 OH) bileşiklerinin kendi molekülleri arasında hidrojen bağları oluştuğu gibi karıştırıldıklarında H2 O ve CH3 OH molekülleri arasında da hidrojen bağları oluşur. Farklı tür moleküller arasında oluşan hidrojen bağları, bu bileşiklerin birbirleri içerisinde çözünürlüklerinin yüksek olmasını sağlar.
Aşağıdaki şekilde farklı tür moleküller arasında oluşan hidrojen bağları görülmektedir.

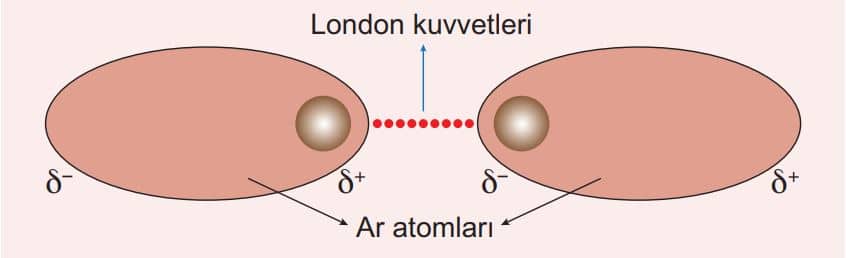
Moleküller arasındaki çekim kuvvetleri ne kadar büyük olursa bileşiğin erime noktası, kaynama noktası gibi fiziksel özellikleri de o kadar yüksek olur. Sadece London kuvvetleri bulunduran bileşiklerde genelde kaynama noktaları düşük, London kuvvetleri ve dipol-dipol etkileşimlerini birlikte bulunduran bileşiklerde ise daha büyüktür. London kuvvetleri, dipol-dipol etkileşimleri ve hidrojen bağlarını içeren bileşiklerde ise genelde beklenenden daha yüksek kaynama noktaları çıkar.
Aşağıdaki grafikte 4A, 5A, 6A ve 7A grubu elementlerinden bazılarının hidrojenli bileşiklerinin kaynama noktaları verilmiştir.

Yukarıdaki grafikte 4A grubu elementlerinin hidrojenli bileşikleri olan CH4 , SiH4 , GeH4 ve SnH4 molekülleri apolar karakterlidir. Kendi molekülleri arasında sadece London kuvvetleri bulunduğundan diğer gruplardaki bileşiklere göre kaynama noktaları düşüktür.
4A grubu bileşiklerinde elektron yoğunluğu arttıkça London kuvvetleri arttığından CH4 , SiH4 , GeH4 ve SnH4 sıralamasında bileşiğin kaynama noktasında artış gözlenir. 5A, 6A ve 7A grubundaki elementlerin hidrojenli bileşikleri polar karakterli olduğu için molekülleri arasında bulunan London kuvvetlerinden çok dipol – dipol çekim kuvvetleri etkilidir. Bunun için kaynama noktaları, aynı periyottaki 4A grubu elementlerine göre daha yüksektir.
Yukarıdaki grafikte incelendiğinde NH3 , HF ve H2 O bileşiklerinin kaynama noktalarının beklenenden yüksek olduğu görülür. Bunun sebebi, bu bileşiklerin molekülleri arasında London kuvvetleri ve dipol – dipol etkileşimlerinin yanında hidrojen bağlarının da bulunmasıdır. Zayıf etkileşimler içinde hidrojen bağları, van der Waals etkileşimlerinden daha sağlamdır. NH3 , HF ve H2 O bileşiklerinin kaynama noktalarının beklenenden yüksek olması bu durumu açıklar.
Sonuç olarak asal gazların ve apolar moleküllerin yoğun fazlarında sadece London kuvvetleri bulunur ve fiziksel özellikler de etkilidir. Polar moleküllerde London kuvvetleri ve dipol – dipol etkileşimleri bulunmasına rağmen kaynama noktasında dipol – dipol etkileşimi etkindir.
London kuvvetleri, dipol – dipol etkileşimleri ve hidrojen bağı gibi zayıf etkileşimleri bulunduran NH3 , HF ve H2 O gibi bileşiklerde ise kaynama noktası gibi fiziksel özelliklerde hidrojen bağı etkindir.
Ancak elektron sayısı çok olan apolar moleküllerde London kuvvetleri, dipollüğü yüksek olan polar moleküllerde de dipol – dipol etkileşimleri önem kazanır.