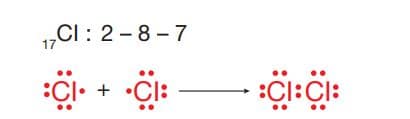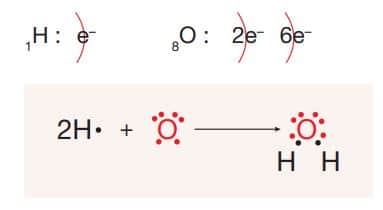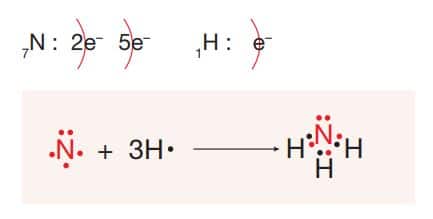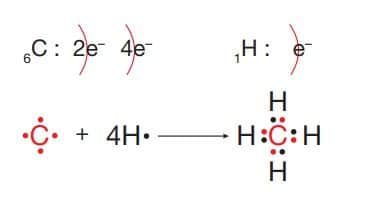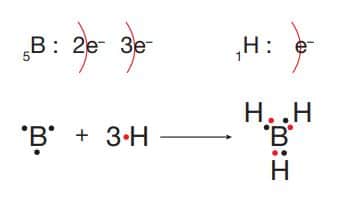Kovalent Bağ Nedir, Kovalent Bağın Özellikleri Nelerdir?
İki tane ametal atomu arasında elektronların ortaklaşa kullanılması ile oluşan çekim kuvvetine kovalent bağ denir.
Ortaklaşa kullanılan elektron sayısı en az ikidir. Bir çift elektronun iki ametal atomu tarafından ortaklaşa kullanılması ile tekli kovalent bağ, iki çift elektron ortaklaşa kullanıldığında ikili kovalent bağ, üç çift elektron ortaklaşa kullanıldığında ise üçlü kovalent bağ oluşur. İkili ve üçlü kovalent bağlara çoklu bağlar denir. H2 molekülünde tekli kovalent bağ, O2 molekülünde ikili kovalent bağ, N2 molekülünde ise üçlü kovalent bağ vardır.
Ortaklaşa kullanılan iki elektron, atom çekirdeklerinin etrafında eşit olasılıkla dolaşıyorsa eşit bir ortaklaşa kullanım vardır. Bu kovalent bağ sadece aynı ametal atomları arasında oluşur ve apolar (kutupsuz) kovalent bağ adını alır.
Polar veya Apolar Molekül
Apolar kovalent bağ aynı iki ametal atomu arasında ortaklaşa kullanılan bir, iki veya üç çift elektrondan kaynaklanan çekim kuvvetidir. Farklı atomlar arasında bir, iki veya üç çift elektron ortaklaşa kullanılıyorsa eşit olmayan bir ortaklaşa kullanım vardır ve polar (kutuplu) kovalent bağ oluşur.
Kovalent yapılı bileşiklerde bağların polar veya apolar olmasından başka molekülün polarlığından da bahsedilir. Molekülün polar veya apolar olduğu, Lewis yapısı yazıldıktan sonra aşağıdaki kurallara göre belirlenir.
- Aynı cins atomdan oluşan iki atomlu moleküllerde bağlar apolar ve elektronların dağılımı dengeli olduğu için molekül de apolar özellik gösterir.
- Farklı cins atomlardan oluşan iki atomlu moleküllerde bağlar polar ve elektronların dağılımı dengesiz olduğu için molekül de polar özellik gösterir.
- Farklı cins atomlardan oluşan ikiden fazla atomlu moleküllerde elektron yoğunluğu dengeli ise molekül apolar, elektron yoğunluğunda dengesizlik varsa molekül polar yapılır.
Polar moleküllerde elektron yoğunluğunun fazla olduğu yerde kalıcı negatif kutup, elektron yoğunluğunun az olduğu yerde kalıcı pozitif kutup oluşur. H2 , O2 ve N2 moleküllerinde atomlar arasındaki çekim kuvvetleri apolar kovalent bağlardan kaynaklanır.
Kovalent Bağların Oluşumu
H2 , O2 ve N2 moleküllerinin Lewis yapılarını yazarak apolar kovalent bağların oluşumunu görelim:
H2 molekülünde atomlar arasında tekli apolar kovalent bağ, O2 molekülünde ikili apolar kovalent bağ, N2 molekülünde üçlü apolar kovalent bağ bulunur.
Her ortaklaşa kullanılan iki elektron bir kovalent bağı temsil ettiğinden ikili bağda iki tane kovalent bağ, üçlü bağda üç tane kovalent bağ olduğu söylenebilir. Bu bağların oluşumunu Lewis yapılarını yazarak gösterebiliriz. Her ortaklaşa kullanılan bir çift elektron, ametal atomları arasında iki nokta ile gösterilir.
H2 , O2 ve N2 molekülleri dengeli elektron dağılımından dolayı apolar yapılı moleküllerdir.
CI2 molekülünün Lewis yapısını göstererek iki tür arasında oluşan çekim kuvvetini tanımlayalım.
Klor atomları arasında bir çift elektron ortaklaşa kullanıldığı için oluşan çekim kuvveti tekli apolar kovalent bağdır. Oluşan molekül dengeli elektron dağılımı gösterdiğinden apolar moleküldür. Aynı ametal atomları arasında apolar kovalent bağlar varken farklı ametal atomları arasında polar kovalent bağlar vardır. Polar kovalent bağ içeren HCI, H2 O, NH3 , BH3 , CH4 ve CO2 gibi bazı basit moleküllerin Lewis yapılarını yazalım:
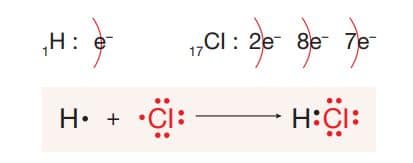
HCI molekülünün Lewis yapısı:
HCI molekülünde H ve CI atomları arasında ortaklaşa kullanılan iki elektron farklı atomlar arasında olduğu için oluşan bağ, polar kovalent bağdır. HCI molekülü dengesiz elektron dağılımında olduğundan molekül polar özellik gösterir.
H2 O molekülünün Lewis yapısı:
H2 O molekülünde H ve O atomları arasında iki tane özdeş tekli polar kovalent bağ vardır. H2 O molekülü dengesiz elektron dağılımında olduğundan molekül polar özellik gösterir.
NH3 molekülün Lewis yapısı:
NH3 molekülünde N ve H atomları arasında üç tane özdeş tekli polar kovalent bağ vardır. NH3 molekülü dengesiz elektron dağılımı gösterdiğinden molekül polar özellik gösterir.
CO2 molekülünün Lewis yapısı:
CO2 molekülünde C ve O atomları arasında iki tane özdeş ikili polar kovalent bağ vardır. CO2 molekülü dengeli elektron dağılımı gösterdiğinden apolar yapılı bir moleküldür.
CH4 molekülünün Lewis yapısı:
Karbon (C) elementi 4A grubunda ametal, hidrojen (H) elementi 1A grubunda ametal özellik gösterir. Oluşan CH4 bileşiği kovalent karakterlidir. Bileşiğin yapısında C ve H element atomları arasında oluşan dört tane özdeş polar kovalent bağ vardır. CH4 molekülü dengeli elektron dağılımı gösterdiğinden apolar yapılı bir moleküldür.
BH3 molekülünün Lewis yapısı:
Bor (B) elementi 3A grubunda yarı metal, hidrojen (H) elementi 1A grubunda ametal özellik gösterir. Oluşan BH3 molekülü elektronların ortaklaşa kullanılması ile oluşan kovalent bir özellik gösterir.
Bileşiğin yapısında üç tane özdeş polar kovalent bağ vardır. BH3 molekülü dengeli elektron dağılımından dolayı apolar yapılı bir moleküldür.