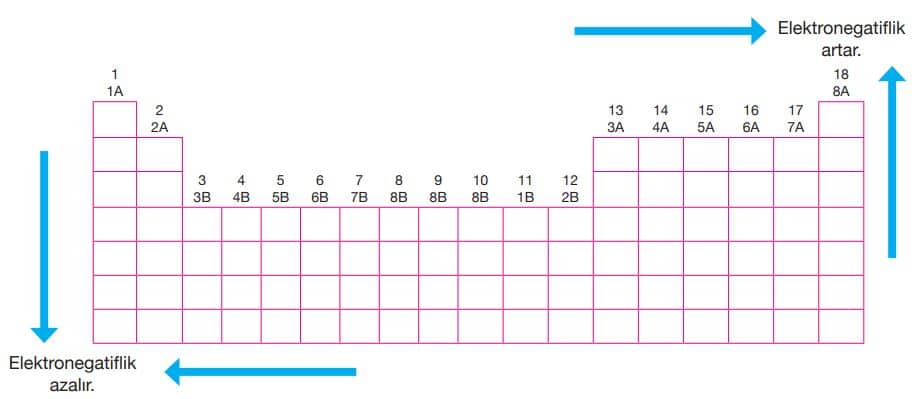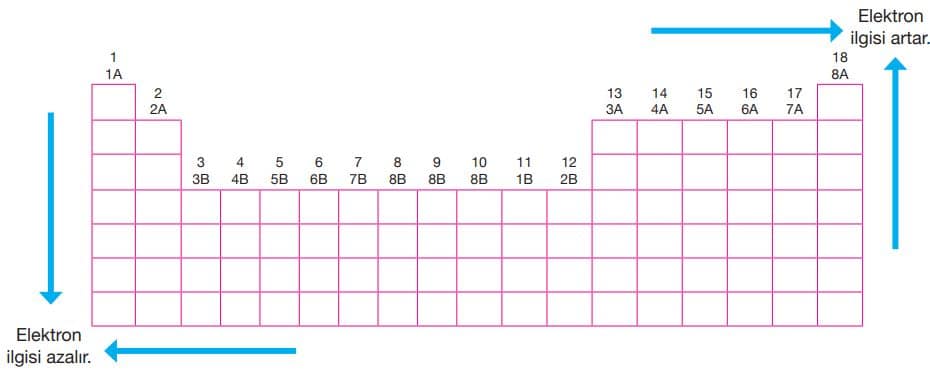
Rutherford Atom Modeli
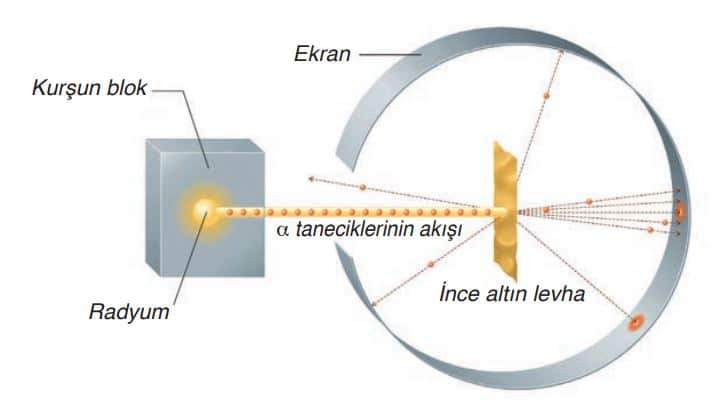
E. Rutherford, radyoaktif özellik gösteren radyum (Ra) elementinden çıkan alfa (a) taneciklerini noktasal bir kaynak hâlinde, çok ince hâle getirdiği altın levha üzerine göndermiştir.
Amacı, pozitif yüklü olduğunu bildiği a taneciklerinin altın levhadaki atomların içinden geçerken nasıl davranacağını gözlemlemek ve yorumlamaktır.
Aşağıdaki şekilde görüldüğü biçimde bir deney düzeneği hazırlayan Rutherford gönderdiği a taneciklerinin ekranda bıraktıkları izleri incelemiş ve atom modelini geliştirmiştir.

Aşağıdaki şekilde görüldüğü gibi a ışınlarının büyük bir kısmı altın levhadaki atomlardan hemen hemen hiç sapmadan geçmiş, az bir kısmı ise sapmış veya geri dönmüştür.

Rutherford Atom Modelinin Varsayımları
- Atomun hacmine göre çok küçük bir hacimde bulunan pozitif yüklü tanecikler merkezde ve yoğun bir şekilde bulunmaktadır. Atomun çekirdeği atoma göre çok küçük bir hacim kaplamaktadır.
- Pozitif yüklerin toplam kütlesi atomun kütlesinin yaklaşık yarısıdır.
- Atomun yapısında çok büyük boşluklar vardır. Çekirdeğin çapı yaklaşık 10–13 cm, atomun çapı ise yaklaşık 10-8 cm boyutundadır.
- Çekirdekteki pozitif yükü dengeleyecek sayıdaki elektronlar atomun çekirdeğinin etrafında bulunurlar.
Rutherford, atom çekirdeği ve etrafında elektronlar şeklinde açıkladığı çekirdekli ve boşluklu atom modeli ile Thomson atom modelini geçersiz hâle getirmiştir. Ancak çekirdek etrafındaki elektronların hareketlerini açıklayamamıştır.
Rutherford, radyoaktif maddeden elde ettiği +2 yüklü alfa taneciklerini çok ince metal yaprak üzerine göndermiştir. Bu ışınların çok büyük bir kısmının sapmadan, az bir kısmının ise saparak metal yapraktan geçtiğini çok az bir kısmının ise geriye yansıdığını saptamıştır.
Rutherford, Thomson atom modeliyle bu sonuçları açıklayamamıştır. Atom homojen bir yapıda olsaydı, bütün a parçacıklarının levhayı geçmesi veya geçmemesi gerekirdi. a taneciklerinden bazılarının çok az sapması veya geri dönmesi, atom içinde (+) yüklü iyonların geçmesini zorlaştıran bir bölümün varlığını gösterdi. Bu nedenle Rutherford, atomda pozitif yükün ve kütlenin atom merkezinde çok küçük hacimde toplandığını düşündü ve bu bölüme çekirdek adını verdi. Deney sırasında sapan veya geri dönen a taneciklerinin çekirdeğe çok yakın gelen veya tam çekirdek üzerine isabet eden tanecikler olduğunu belirtti.
Rutherford atom modelinin varsayımları şunlardır:
1. Atomda pozitif yük ve kütle, atom merkezinde çekirdek olarak adlandırılan çok küçük bir hacimde toplanmıştır. Atomun yarıçapı 10-10 m, çekirdeğin yarı çapı 10-15 m civarındadır.
2. Çekirdekteki pozitif yük miktarı bir elementin bütün atomları için aynı ve diğer atomlarınkinden farklıdır. Pozitif yük sayısı atom kütlesinin yaklaşık yarısına eşittir. 3.Atomların nötrlüğünü sağlamak üzere, proton sayısına eşit sayıda elektron, çekirdek etrafında bulunur. Atom hacminin büyük bir bölümü, çok hızlı hareket eden elektronlar tarafından doldurulur.
Rutherford modeli atomdaki elektronların hareketlerini açıklayamadığı gibi elektronların niçin çekirdek üzerine düşmedikleri sorusunu da yanıtlayamamaktadır.
Dalton, Thomson ve Rutherford atom modellerinde proton ve nötronlarla ilgili bilgiler verildi. Daha sonraki yıllarda Chadwick, atom çekirdeğinde nötron denilen yüksüz bir taneciğin varlığını saptamıştır. Bu şekilde, atomun üç temel tanecikten oluştuğu anlaşılmıştır. Daha sonraki yıllarda atomda, proton, nötron ve elektronun yanı sıra çok sayıda taneciğin bulunduğu anlaşılmıştır. Ancak atomların davranışlarını proton, nötron ve elektron sayıları belirler.
Atomu Oluşturan Temel Tanecikler
Atomun temel tanecikleri, atom çekirdeğinde bulunan protonlar ve nötronlar ile çekirdeğin çevresinde bulunan elektronlardır.
| Tanecik | Bulunduğu yer | Bağıl kütle(akb) | Bağıl yük |
| Proton(p+) | Çekirdek | 1 | +1 |
| Nötron(n) | Çekirdek | 1 | 0 |
| Elektron(e–) | Çekirdek dışı | 1/1836 | -1 |
Proton sayısı : Atomları birbirinden ayıran temel sayıdır. Bir elementin tüm atomlarında proton sayısı aynı, farklı element atomlarında proton sayısı farklıdır.
Nötron sayısı: Çekirdekteki yüksüz parçacıktır. Bir elementin tüm atomlarında farklı ( izotop ), farklı element atomlarında aynı ( izoton ) sayıda olabilir.
Elektron sayısı: Kimyasal davranışı belirler. Bir atomun elektron sayısı değişince kimyasal özelliği değişir.
Çekirdekte bulunan taneciklere (p+n) nükleon denir.
Elementler sembollerle gösterilir. Sembol aynı zamanda o elementin atomunu da belirtir.
Herhangi bir elementin sembolünün sol üst köşesinde kütle numarası, sol alt köşesinde atom numarası sağ üst köşesinde ise iyonun ise yükü belirtilir.
Atom numarası = proton sayısı =çekirdek yükü = nötr atomdaki elektron sayısı
Kütle numarası = proton sayısı+nötron sayısı = nükleon sayısı
Atomlar, sürtme, ısı ve ışık enerjisi gibi etkilerle elektron kazanarak negatif yüklü veya elektron kaybederek pozitif yüklü hale gelebilir. Yüklü atomlara iyon denir. Negatif yüklü iyonlara anyon, pozitif yüklü iyonlara da katyon denir. İyon yükü (q), iyondaki proton ve elektron sayıları arasındaki farka eşittir.
Yük : elektron vererek ( yükseltgenme) ya da elektron alarak (indirgenme) ulaşılan değerliktir.
Yük = proton sayısı – elektron sayısı
p+ = e– Nötrdür.
p+ > e– Katyondur.
p+ < e– Anyondur.
1910 da F. Soddy (F. Sodi) radyoaktiflikle ilgili çalışmalar yaparken uranyum atomunun farklı kütleli atomlarını bulmuş bu atomlara izotop adını vermiştir.
İzotop : ( bX – cX ) Atom numaraları aynı, kütle numaraları farklı olan atom ya da iyonlara denir. Başka bir deyişle proton sayıları aynı, nötron sayıları farklı olan atom ya da iyonlardır.
Örneğin H ‘nin doğada üç izotopu vardır:
Hidrojen, H ; 1 p , 0 n
döteryum D ; 1 p , 1 n
trityum T ; 1 p , 2 n içerir.
İzotop atomların ;
*Kimyasal özellikleri aynı, fiziksel özellikleri farklıdır.
* Bir elementle oluşturdukları bileşik formülleri aynı, mol kütleleri farklıdır.
* Doğada bulunuş yüzdeleri farklıdır.Bu nedenle elementler için ortalama atom kütlesinden bahsedilir.
Ortalama Atom kütlesi:
İzotopların doğadaki bolluk yüzdelerine göre kütlelerinin toplamıdır.
Ortalama atom kütlesi:%.KN1 + %.KN2 +..
İzobar : ( bX – bY )
Atom numarası farklı, kütle numarası aynı olan atomlara izobar atom denir. İzobar atomların fiziksel ve kimyasal özellikleri farklıdır. Na-24 ve Mg-24 birbirinin izobarıdır.
İzoton :
Atom ve kütle numaraları farklı nötron sayıları aynı olan atomlara izoton atom denir. İzobar atomların fiziksel ve kimyasal özellikleri faklıdır.
19K(39) ve 20Ca(40) birbirinin izotonudur. K nın nötron sayısı 39-19 dan 20, Ca nın 40-20 den yine 20 dir. Nötron sayıları eşit olduğu için bu iki element birbirinin izotonudur.
izoelektronik : Elektron sayıları aynı olan farklı atom ya da iyonlar. 11Na+1 ve 9F-1 iyonlarında eşit sayıda yani 10 ar elektronu vardır. Bu iki iyon birbirinin izoelektroniğidir.
allotrop :
Bir elementin aynı cins atomlarının farklı bağlanmış kristal ya da molekül şekillerinden her biri birbirinin allotropudur.
Bazı elementlerin allotropları şöyledir:
Karbon: elmas ve grafit
Oksijen: oksijen ve ozon
Kükürt: rombik, amorf ve monoklin kükürt
Fosfor: beyaz, siyah ve kırmızı fosfor Allotropların ;
- Atomlar arası bağ yapıları farklıdır.
- Bağ yapılarının farklı olması nedeniyle fiziksel özellikleri farklıdır.
(görünüm, erime ve kaynama sıcaklıkları, öz kütle ….)
- Başka elementlerle tepkimeye girme yatkınlığı farklıdır.
· Bir başka elementle oluşturduğu bileşiklerin formülleri aynıdır.