İyonlaşma Enerjisi ve İyonlaşma Enerjisinin Özellikleri
Gaz hâlindeki bir mol atomdan bir mol elektron koparmak için atoma verilmesi gereken en az enerjiye iyonlaşma enerjisi denir. İyonlaşma enerjisi I harfi ile gösterilir. Birimi kJ/mol (kiloJoule/mol) cinsinden verilir.
Atomdan (X) bir elektron koparmak için gereken en az enerji, birinci iyonlaşma enerjisi (I 1 ); X+ iyonundan ikinci elektronu koparmak için gereken enerji, ikinci iyonlaşma enerjisi (I 2 ) olarak tanımlanır. Bu şekilde bir atomun üçüncü, dördüncü iyonlaşma enerjilerinden bahsedilebilir. Ancak bir element atomunun nötr atomundaki elektron sayısı kadar iyonlaşma enerjisi değeri olabilir. Örneğin 3 Li element atomunun dördüncü iyonlaşma enerjisinden bahsedilemez.
I¹ değeri lityum atomunun birinci iyonlaşma enerjisi, l² ikinci, l³ ise üçüncü iyonlaşma enerjisidir. Atom numarası 3 olan Li element atomunun koparılabilecek dördüncü bir elektronu yoktur.
Nötr bir atomdan, l¹ enerjisi verilerek bir elektron koparıldığında çekirdeğin kalan her bir elektrona uyguladığı çekim gücü arttığı için iyonun yarıçapı nötr atomdan daha küçük hâle gelir. Bu durumda ikinci elektronu koparmak için daha çok enerji gerekir. Bunun için bütün atomlarda bir sonraki iyonlaşma enerjisi her zaman bir öncekinden büyüktür.
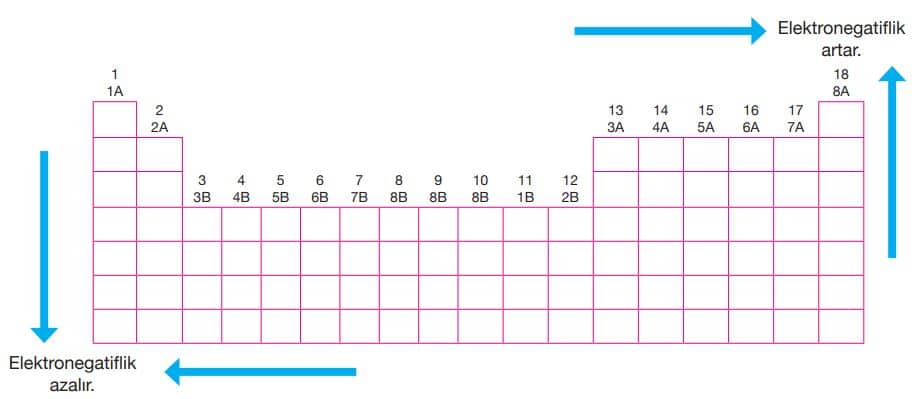
Periyodik sistemde, bir periyotta sağ tarafa doğru gidildikçe çekirdeğin çekim gücü artar, atom yarıçapı küçüldüğü için iyonlaşma enerjisi de genel olarak artar. Ancak bir periyottaki 2A ve 5A grubu elementlerinin kararlı katman-elektron dağılımından dolayı iyonlaşma enerjileri kendilerinden bir sonra gelen 3A ve 6A grubu elementlerinden daha büyüktür.
İlk üç periyot için gruplara göre 1. iyonlaşma enerjisindeki (l¹ ) artış sıralaması aşağıdaki tabloda verilmiştir.

Periyodik sistemde bir grupta aşağıya doğru gidildikçe enerji düzeyi sayısı arttığından son enerji düzeyindeki elektronlar atom çekirdeğinden uzaklaşır ve atom yarıçapı artar. Atom yarıçapı daha büyük bir atomdan son yörüngedeki elektronları koparmak daha kolay olur. Periyodik sistemde bir grupta aşağıya doğru inildikçe iyonlaşma enerjisi azalır.

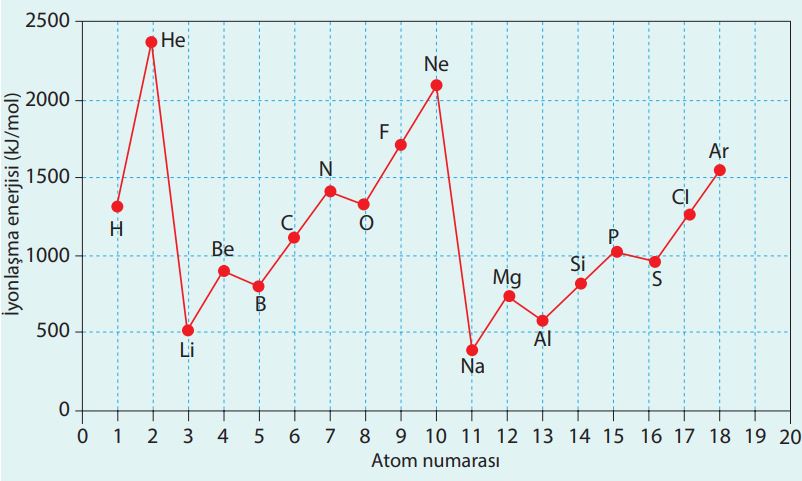
Grafikte ilk üç periyottaki elementlerin atom numaralarına göre iyonlaşma enerjilerindeki değişim görülmektedir.