Bohr Atom Modeli
Işık bir ortamda yol alırken doğrusal yayılır ancak ortam yoğunluğu değiştiğinde kırılır. Havadan suya geçen veya bir prizmadan geçen ışık kırınıma uğrar. Farklı renkteki ışıkların farklı dalga boyları vardır.
Işığın kırınıma uğrama şiddeti dalga boyu ile ilgilidir. Dalga boyu küçük olan ışık demeti çok kırılırken, dalga boyu büyük olan ışık demeti daha az kırılır.
Beyaz ışık (Güneş ışığı) bir prizmadan geçirildiğinde yapısındaki farklı dalga boyundaki ışıklara (renklere) ayrılır. Bu şekilde kırmızıdan mor renge kadar değişen kesintisiz bir spektrum oluşur. Bu tür spektrumlara sürekli spektrum denir.

Gaz hâlindeki maddenin atomları yüksek sıcaklıklara getirildiğinde veya elektrik akımı verildiğinde elektronlar kararsız hâle gelirler. Bu yüksek sıcaklıktaki maddenin atomları yüksek enerjiden kurtulmak için ışıma yaparlar. Her element atomunun yaptığı ışıma farklıdır. Bu ışımalar bir prizmadan geçirilirse farklı dalga boylarına ayrılarak bir spektrum oluştururlar. Bu tür spektrumlara atomun ışıma (yayınma) çizgi spektrumu denir. Bu spektrum kesiklidir.
Soğuk bir maddenin yapısındaki atomlar ise üzerine gelen beyaz ışıktaki bazı ışınları absorblar. Absorblanan ışınlar, ışıma spektrumunda yayılan ışınlardır. Bunun sonucunda beyaz ışığın sürekli spektrumunda siyah çizgiler oluşur. Bu şekilde elde edilen atom spektrumlarına soğurma (absorbsiyon) çizgi spektrumu denir. Bir atomun ışıma ve soğurma çizgi spektrumlarındaki çizgiler aynı dalga boyundaki ışımalardır. Örneğin hidrojen atomunun ışıma ve soğurma çizgi spektrumları aşağıdaki şekilde görülmektedir.

Elementler dışarıdan enerji aldıklarında, çekirdek yapılarına göre farklı sayıda ve yörüngede elektronları bulunduğundan, kendilerine özgü dalga boylarında ışıma yaparlar. Bu ışıma sonucunda her elementin farklı bir ışıma çizgi spektrumu oluşur. Bu spektrum o elementin kimlik kartı gibidir. Aşağıdaki şekilde lityum, oksijen ve karbon elementlerinin farklı ışıma spektrumları görülmektedir.

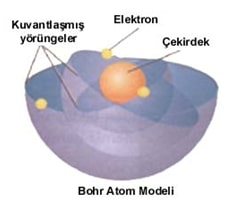
Elementlerin ışıma ve soğurma çizgi spektrumlarını inceleyen Henry G. J. Moseley (Henri G.J. Mozlıy), her elementin atom numarasını (proton sayısını) doğru bir şekilde tespit etmiştir. Atom numarasının atom çekirdeğinde bulunan pozitif yüklü tanecikler olduğunu öngören bilim insanı da Moseley’dir. Niels Bohr (Niıl Bohr) yapılan çalışmaları ve belirlenen atom spektrumlarını kullanarak hidrojen atomu için çekirdeğin etrafında belirli yörüngelerde hareket eden elektronlardan oluşan basit bir model oluşturmuştur. Bu model sadece hidrojen ve tek elektronlu bazı iyonların davranışlarını açıklasa da günümüzde her atomun elektronik yapısının açıklanması için kullanılabilmektedir.
Bohr Atom Modeli Varsayımları
Bohr geliştirdiği atom modeli için aşağıdaki varsayımları ortaya atmıştır:
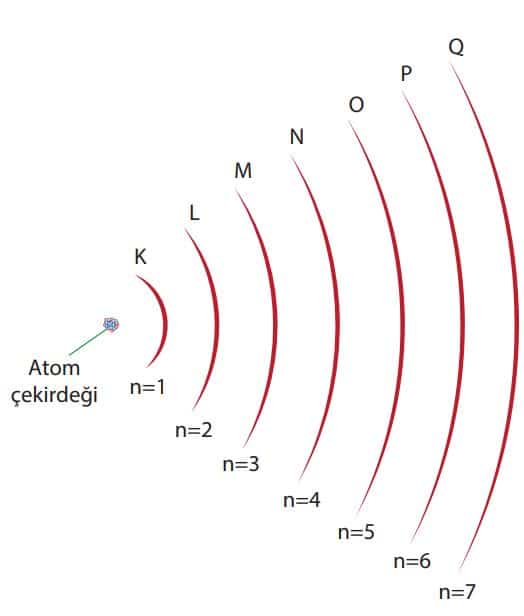
- Elektron, çekirdeğin etrafındaki dairesel yörüngelerde hareket eder. Enerji düzeyi olarak tanımlanan her yörüngenin belirli bir enerjisi vardır. Enerji düzeyleri harflerle (K, L, M, N, O, P, Q) veya rakamlarla (n = 1, n = 2 … n = 7) gösterilir. Aşağıdaki şekilde yörüngeli atom modeli olarak bilinen Bohr atom modelinde elektronların bulunabileceği yörüngeler görülmektedir.
-
- Bohr atom modelinde yörüngeler
- Hidrojen atomunda bulunan bir elektron en düşük enerji düzeyinde (n = 1) bulunmak ister. Enerjisi en düşük olan bu durum temel hâldir. Ancak atoma dışarıdan enerji verildiğinde elektron, üst enerji düzeylerine çıkarılabilir. Bu durumdaki atom uyarılmış hâldedir. Atoma yeterli enerji verildiğinde elektronu koparılabilir. Bu durum iyon hâldir.
- Bir elektron, üst enerji düzeylerine çıkarken enerji alır ve kararsız hâle gelir. Tekrar alt enerji düzeylerine inerken de aldığı enerjiyi dışarıya verir. Bu durumda ışıma yapar. Bu ışıma da bir prizmadan geçirilerek atom spektrumu elde edilir.
Rutherford atom modeli çekirdek çevresinde bulunan elektronların hareketlerini fizik yasalarına göre açıklamakta yetersiz kalmıştır. Bunun üzerine Danimarkalı Fizikçi Bohr bir elektronlu olan atom ya da iyonlar (1H, 2He+1, 3L+2…) için bir atom modeli geliştirmiştir.
Bohr atom modelinin varsayımları şunlardır:
- Elektronlar çekirdek çevresinde yarı çapı belli dairesel yörüngelerde bulunabilir. Bu yörüngelere enerji düzeyi de denir. Yörüngeler çekirdeğe yakınlık sırasına göre ya K, L, M… gibi harflerle, ya da 1, 2, 3, …n gibi tam sayılarla gösterilir. Her enerji düzeyinin belirli bir enerjisi vardır.
- 2. Çekirdeğe en yakın enerji seviyesinin enerjisi en küçüktür. Çekirdekten uzaklaştıkça yörüngelerin enerjisi artar. Hidrojen atomunda bir elektron en düşük enerjili yörüngede bulunur. Bu yörüngelerden birinde bulunan elektron kendiliğinden enerji yaymaz. Elektronu olası en düşük enerjili yörüngelerde bulunan atomun elektron dizilişine temel hal elektron dizilişi denir. Atom dışarıdan enerji kazanırsa elektron aldığı enerjinin değerine bağlı olarak daha yüksek enerjili bir düzeye sıçrar. Böyle elektronlara uyarılmış elektron, atomlara da uyarılmış atom denir. Uyarılmış elektron, daha düşük enerjili bir düzeye düşerken hareket ettiği iki enerji düzeyi farkına eşit enerjiyi dışarıya verir.
Bohr Atom Modelinin Eksik Yönleri
Bohr modeli Rutherforad atom modeline göre oldukça üstün tarafları olsa da bu kuramında eksik yönleri söz konusudur. Elektronun, maddesel nokta şeklinde düşünüldüğünden, yörünge üzerinde enerji yayımlamadan dönüşleri, yörüngeden yörüngeye atlayışı ve açığa çıkan enerjinin ışıma halinde alınıp verilmesi açıklanması kolay olmayan bir durumdur. Bohr atom modeli yalnızca tek elektronlu sistemlerin spektrumlarını açıklayabilir. Ve çok elektronlu sistemlerin spektrumlarıı açıklamakta yetersiz kalır. Çok elektronlu atomların spektrumlarında enerji düzeylerinin her birinin iki ya da daha fazla düzeye ayrıldığı görülmektedir. Yine hidrojen gazı, bir elektrik alanı veya magnetik alanda soğurma spektrumları incelenirse, enerji düzeylerinin çok elektronlu sistemlerde olduğu gibi iki ya da daha fazla enerji düzeyine ayrıldığı görülür.


bu yazıyı kim yazdığını nasıl öğrenebilirim acaba?