Atomların Elektron Dizilimleri
Elektronlar orbitallere doldurulurken atomun enerjisi en düşük olacak şekilde doldurulması gerekir. Bu durum ancak elektronların en düşük enerjili orbitalden en yüksek enerjili orbitale doğru doldurulması ile gerçekleşir.
Orbitallerin enerji sıralaması 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p şeklindedir. Enerji sıralamasının akılda kalması ve öğrenilmesi kolay olmayabilir. Kalıcılığı sağlamak için farklı yöntemler kullanılabilir. Bu yöntemlerden biri aşağıdaki periyodik sistemi göz önünde bulundurarak orbital ve blokları ilişkilendirmektir (Tablo 1.2.4).
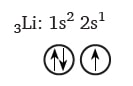
Enerji sıralamasını öğrenmenin başka bir yöntemi de yandaki gibi bir şema yaparak çizgileri ok yönünde takip etmektir. Lityum atomunun elektron dizilimi ve orbital şeması incelendiğinde atom numarasının üç olduğu görülür. Bu nedenle nötr durumda elektron sayısı da üç olmalıdır. Elektron dizilimine birinci enerji düzeyinden başlanır. Birinci enerji düzeyinde sadece s orbitali bulunur. s orbitali maksimum 2 elektron bulundurduğundan lityumun iki elektronu 1s orbitaline, kalan bir elektronu ise ikinci enerji düzeyinin s orbitaline yerleşir. Enerji sıralamasına göre lityum elementinin elektron dizilimi ve orbital şeması aşağıda verilmiştir.
Elektron dizilimini yazarken uygulanacak pratik bir yol da kendinden önceki soy gazın elektron diziliminden yararlanmaktır. Bu yöntemle yazılan lityum atomunun elektron dizilimi,