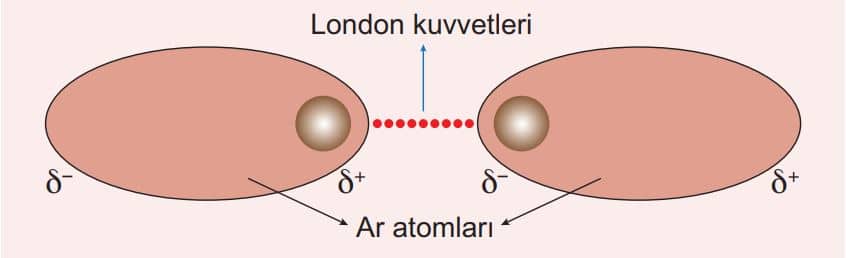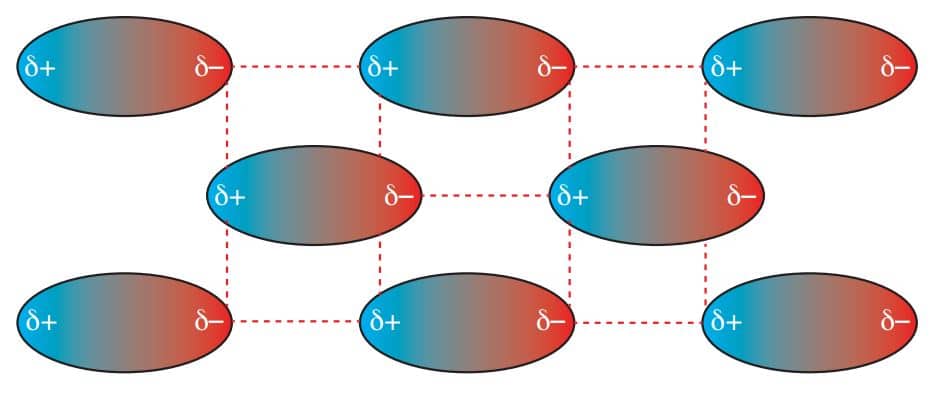
İyon-Dipol Etkileşimleri
Polar kovalent karakterdeki kalıcı dipoller ile iyonik bir bileşikten gelen iyonlar arasında oluşan çekim kuvvetleri iyon – dipol etkileşimleridir.
Moleküldeki pozitif kutup ile negatif yüklü iyonlar ve moleküldeki negatif kutup ile pozitif yüklü iyonlar arasında oluşan çekim kuvvetidir.

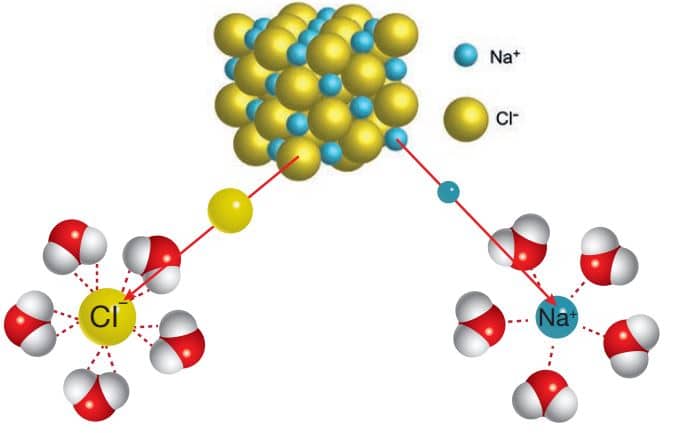
Yemek tuzu (NaCl) iyonik bir bileşiktir ve suda iyonlarına ayrışarak çözünür. Bu çözünme sonucunda pozitif yüklü sodyum iyonu (Na+ ) ve negatif yüklü klorür iyonu (Cl– ) oluşur. Şekil 3.9’da Na+ ve Cl– iyonları ile H2 O molekülleri arasında oluşan iyon-dipol etkileşimleri görülmektedir.
Yemek tuzu suda Cl– – H2 O ve H2 O – Na+ olarak gösterebileceğimiz iyon – dipol etkileşimleri yardımı ile çözünür.
Dipol-İndüklenmiş Dipol Etkileşimleri
Polar yapılı bir maddenin apolar yapılı bir çözücüde veya apolar yapılı bir maddenin polar yapılı başka bir çözücüde çözünmesi sırasında çözücü ve çözünen türleri arasında oluşan etkileşim türüdür.
Polar olmayan molekülün veya atomun elektron dağılımı, polar molekül tarafından uygulanan kuvvete bağlı olarak bozulur. Bunun sonucunda da farklı bir dipol şekli ortaya çıkar.
Polar olmayan molekülde geçici bir dipolleşme olur. Geçici dipolleşme atom veya molekülün yakınında bulunan polar bir molekülden kaynaklandığı için indüklenmiş dipol olarak bilinir. İyot (I2 ) molekülü apolar yapılı, metil alkol (CH3 OH) molekülü ise polar yapılıdır. I2 maddesinin CH3 OH içinde çözünmesi dipol – indüklenmiş dipol etkileşimleri sonucunda oluşur.
İndüklenmeyi gerçekleştiren CH3 OH molekülüdür.
İyon-İndüklenmiş Dipol Etkileşimleri
İyonik yapılı maddelerin apolar yapılı bir sıvı ile karışması sırasında çözücü ve çözünen türleri arasında oluşan etkileşim türüdür.
Polar olmayan molekülün elektron dağılımı, iyonik yapılı maddede bulunan iyonlar tarafından uygulanan çekim kuvveti ile bozulur. Bu şekilde polar olmayan molekülde geçici bir dipolleşme oluşur.
İyonik katıdaki iyonlar ile geçici dipolleşmiş moleküller arasında iyon – indüklenmiş dipol etkileşimi oluşur. İyon – dipol etkileşimine göre daha zayıf olan bu etkileşim, dipol – indüklenmiş dipol etkileşiminden kuvvetlidir.
Sodyum klorür (NaCI) iyonik katısı ile karbon tetraklorür (CCI4 ) sıvısı karıştırıldığında Na+ ve CI– iyonları ile CCI4 molekülleri arasında anlık iyon – indüklenmiş dipol etkileşimleri oluşur. Bu etkileşim NaCI katısının yapısındaki iyonlar arasında bulunan güçlü iyonik bağı koparamaz. Sonuçta NaCI iyonik katısı, apolar yapılı CCI4 sıvısında çözünmez.