Kimyasal Dengeye Etki Eden Faktörler (Le Chatelier Prensibi)
Dengede olan bir sistem bazı faktörlerin değişmelerinden etkilenir.Sistemde denge tekrar kuruluncaya kadar reaksiyon ileri yada geri yönde tekrar başlar.
Dengeye etki eden faktörler şunlardır:
- Reaktif veya ürünlerin reaksiyon kabına ilave edilmesi yada çıkarılması(Derişim)
- Hacim veya Basıncın etkisi
- Sıcaklığın etkisi
- Katalizörün etkisi
Kimyasal dengeye etki eden faktörler üzerine geniş çaplı çalışmayı Henri-Louis Le Chatelier yapmıştır.Kendi ismiyle anılan Le-Chatelier prensibine göre;
Eğer dengede olan bir sisteme sıcaklık,basınç ve derişimin değiştirilmesi ile bir etki yapılırsa, reaksiyon o etkiyi azaltacak yönde reaksiyon vererek (tepki göstererek) tekrar dengeye ulaşır.
Şimdi dengeye etki eden bu faktörleri tek tek ele alalım;
Derişimin (Konsantrasyonun) Etkisi
Denge halindeki bir sisteme reaktif veya ürünlerden biri ilave edilirse o maddelerin derişimi artar.Denge bu maddeyi ve etkisini azaltacak yönde sağa yada sola kayar.Madde ilavesi reaksiyon denkleminin hangi tarafına yapılmış ise o tarafın hızı artar.Ancak bir süre sonra ileri ve geri yöndeki reaksiyon hızları eşitlenerek yeni denge kurulur.Bununla birlikte derişim değişikliğinin denge sabitinin sayısal değerine etkisi yoktur .
Kısacası;
- Eğer bir bileşen (reaktif veya ürün) dengedeki bir sistemden çıkarılırsa denge, etkiyi azaltacak yönde (sağa yada sola) kayar ve reaksiyondan çıkarılan bileşenden daha çok üretmeye başlar.Sistem tekrar dengeye ulaşıncaya kadar bu işlem devam eder.
- Eğer bir bileşen (reaktif veya ürün) dengedeki bir sisteme ilave edilirse denge, etkiyi azaltacak yönde (sağa yada sola) kayar ve reaksiyona eklenen bileşenden daha çok tüketmeye başlar.Sistem tekrar dengeye ulaşıncaya kadar bu işlem devam eder.
Derişimin etkisini aşağıdaki reaksiyonda inceleyelim:
N2(g) + 3H2(g) ←→ 2NH3
Dengede olan bu sisteme H2 eklersek ne olur?
- Grafikten de anlaşılacağı gibi H2 eklenene kadarki derişimler eşit olduğundan sistem dengededir.
- Sisteme H2 ilave ettiğimizde sistem eklenen H2 nin bir kısmını tüketip NH3 üretecektir.İleri yöndeki reaksiyon hızlanacaktır.
Sistem tekrar dengeye ulaştıktan sonraki derişimleri karşılaştırıp grafiğe göre yorumlayalım.
H2: Dengeye ulaştıktan sonraki derişimi daha fazla olur.Çünkü H2 nin tamamı değil sadece bir kısmı NH3 üretmek üzere kullanılıyor.
N2: Dengeye ulaştıktan sonraki derişimi daha az olur.Çünkü H2 eklendikten sonra H2 ile birlikte NH3 oluşturmak üzere bir miktar da N2 kullanılacaktır.(Fakat sisteme H2 değil de N2 eklenseydi N2 nin bir kısmı kullanılacağından tekrar dengeye ulaştıktan sonraki derişimi fazla olurdu.)
NH3: Dengeye ulaştıktan sonraki derişimi daha az olur.Çünkü H2 eklendikten sonra sistem NH3 üretiyor.
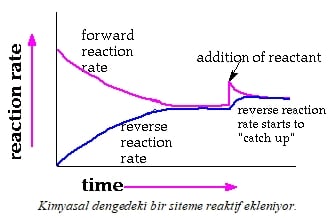
Derişimin etkisindeki bir reaksiyonun reaksiyon hızı-zaman grafiği aşağıdaki gibi olur.
Basınç ve Hacmin Etkisi
Basınç veya hacim sadece gaz reaksiyonlarında etkilidir.Bir gaz reaksiyonundaki reaksiyon kabının hacmini değiştirince(basıncı değiştirince) sistemdeki tüm maddelerin derişimleri değişecektir.Örnek olarak aşağıdaki reaksiyonu ele alalım:
N2(g) + 3H2(g) ←→ 2NH3
Bu reaksiyonun hacmini yarıya indirelim.Bu durumda basıncın iki katına çıkması gerekir.Ancak Le Chatelier prensibi gereğince sistem basıncı azaltacak yönde tepki gösterir ve tekrar dengeye gelmek ister.Bu da ancak sistemin sağa doğru kaymasına yani NH3 üretmesiyle mümkündür.Reaksiyon yeniden dengeye geldiğinde NH3 ün mol sayısı artmış,N2 ve H2 nin mol sayıları ise azalmıştır.Toplam mol sayısındaki bu azalma basıncın 2 kattan daha küçük olması sonucunu doğurur.Böylece sistemin hacminin küçülmesi,daha çok ürün oluşmasına neden olur.Basıncın denge sabitinin sayısal değerine etkisi yoktur.
Genel olarak basınç veya hacmin etkisini ele alırsak;
- Bir gaz dengesinde hacmin küçültülmesi,dengenin daha az mol sayısı içeren gazlar tarafına kaymasına neden olur.Hacmin artması ise dengenin daha fazla mol sayısı içeren gazlar tarafına kaymasını sağlar.
- Yukarıdaki ifadelerden çıkarılabileceği gibi reaktif ve ürün mol sayıları eşit olan reaksiyonlarda basıncın etkisi yoktur.Bu ifadeye örnek bir reaksiyon;
N2(g) + O2(g) ←→ 2NO(g)
yazılabilir.Görüldüğü gibi ürünlerde 2 mol girenlerde de 2 mol madde vardır.
- Reaksiyon kabın,reaksiyona katılmayan bir gaz ilave edilirse,kapta toplam basınç artmakla beraber,reaktif ve ürün gazlarının kısmi basınçları değişmeyeceğinden denge de değişmez..
Aşağıdaki tabloda bazı reaksiyonlarda hacmin(basıncın) etkisi gösterilmiştir:
| Sistem
|
Hacim Artışı
(Basınç Azalması)
|
Hacim Azalması(Basınç Artışı)
|
|
1. N2O4(g) ←→ 2NO2(g)
2. SO2 + 1/2O2(g) ←→ SO3(g)
3. N2(g) + O2(g) ←→ 2NO(g)
|
→ → →
←←←
Denge Bozulmaz |
←←←
→ → →
Denge Bozulmaz |



Çok teşekkürler, aklıma yatmayan bir detayı öğrenmiş oldum sayenizde.